自2019年伊始,随着《人类遗传资源管理条例》(下称“条例”)和《生物安全法》相继实施,标志着我国人类遗传资源管理制度的框架已然建构完成,“生物疆域”成为国家核心利益的重要组成部分。实务中,由于前述法规多为原则性规定,从高位阶的法律规范到企业内部的合规指引之间仍有很大距离,有赖配套规定予以明确。2022年3月22日,科技部回应公众关切,发布了《人类遗传资源管理条例实施细则(征求意见稿)》(下称“征求意见稿”),公开征求意见。本文旨在梳理条例和征求意见稿,释明监管思路,厘清我国人类遗传资源管理制度的要点,提出针对性的实操建议,助力生物医药企业在人类遗传资源合规工作中乘风破浪。
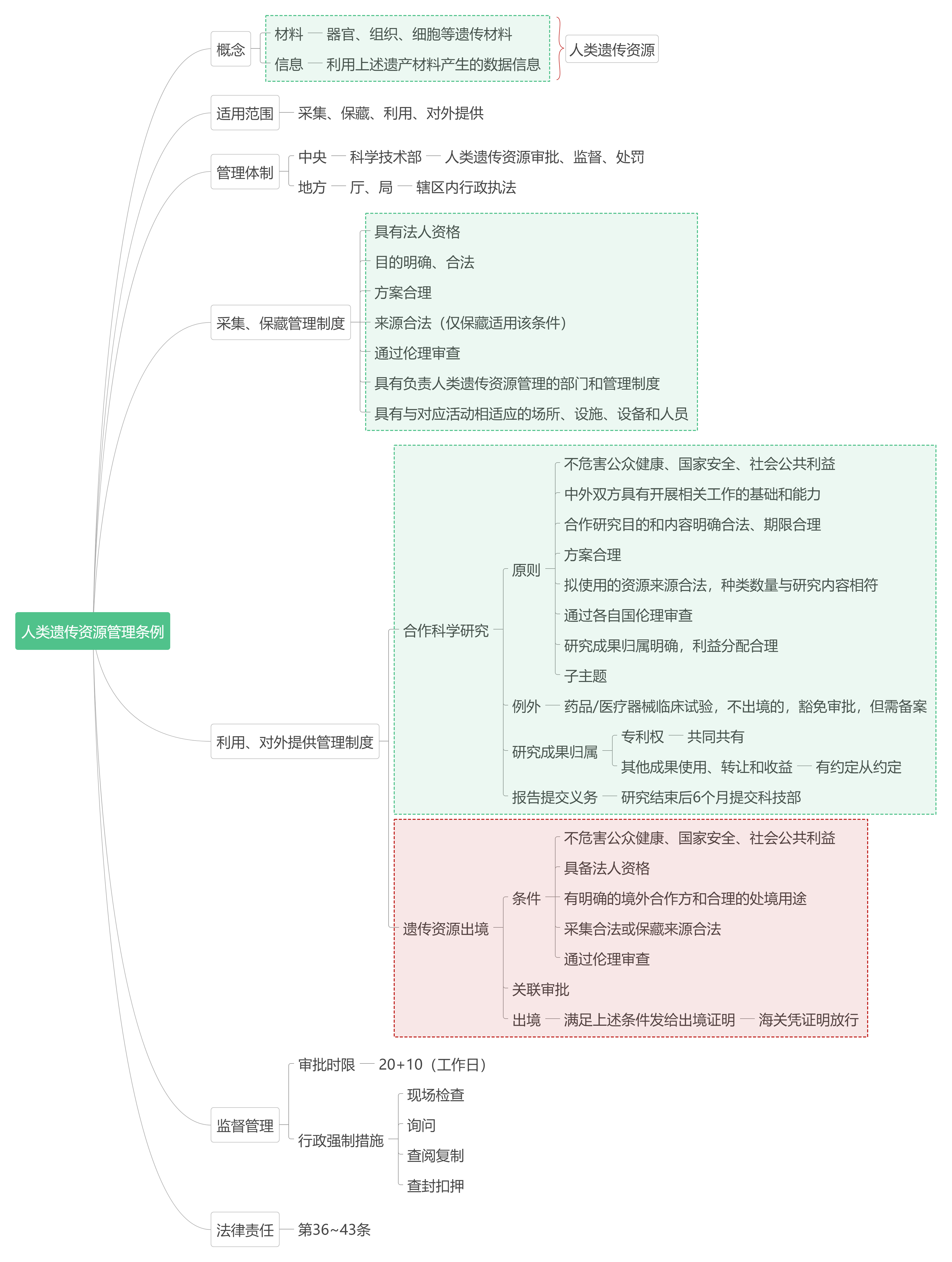
一、概念及适用范围
结合条例、征求意见稿确定的定义,人类遗传资源包含人类遗传资源材料和人类遗传资源信息。人类遗传资源材料指向器官、组织、细胞等遗传材料;人类遗传资源信息指向由材料产生的人类基因、基因组数据等信息资料。因此关于“信息”的定义,应当限缩为由遗传材料产生的我国人类基因以及基因组信息,不宜作扩大解释为从遗传材料衍生、包括二次处理的数据或结果。我国的人类遗传资源管理制度主要围绕采集、保藏、利用、对外提供这四个环节规制,但针对临床诊疗、采供血服务、查处违法犯罪、兴奋剂检测和殡葬等活动采集、保藏器官、组织、细胞等人体物质及开展相关活动的,无论是条例抑或是实施细则,均明确规定依照相关法律、行政法规执行。因此,如果在生物医药企业合规的实操中,如业务范围落入了上述领域,亦有援引该条款继而排除条例、实施细则适用的可能。
二、监管体制
本次的征求意见稿有相当大的篇幅,规定了主管机关的权责、行政处罚程序、管辖等一系列事项,这也标志着人类遗传资源活动的强监管、闭环监管、科学监管的时代即将到来。征求意见稿再一次重申了科技部对全国范围内人类遗传资源审批、监督、处罚等管理工作的权能,尽管新规定了相关事业单位可受科技部委托,承担许可受理、专业支撑、监督管理等方面的具体支撑工作,但针对行政许可等事项的审批权仍未下放至省级,省级主管机关仍然仅负责辖区的行政执法活动。值得一提的是,省一级主管机关对于“违法案件”的查处是否包含“违规”,在实践中仍有待进一步明确。除此之外,本次征求意见稿鼓励执法力量的建设,要求加强人类遗传资源监管力量,配备执法检查人员和执法辅助人员,同时配套专家咨询机制,为人类遗传资源管理提供决策咨询和技术支撑。与此同时,征求意见稿第13条也规定了相关单位的主体责任,要求加强企业的合规建设,因此,对于生物医药企业而言,合规制度建设工作是细则实施后的一个工作重点,事实上律师在这一点上能为企业提供的法律服务其实非常广阔,包括协助企业人类遗传资源合规管理制度方面的设计,协助企业做好应急管理,跟监管机构沟通等等。
三、中方单位和外方单位的认定
征求意见稿明确在我国境内采集、保藏、对外提供应当为中方单位,同时利用我国人类遗传资源开展科学研究活动的,也应当以与中方合作的方式进行。因此,如何认定中方和外方,以及何种情形下可以评价为外方实际控制,这既攸关国家安全,亦关系到外资参股的生物医药企业的切身利益,在过去条例的实施过程中极易产生争议,亦困扰业界良多。在实务中,科技部的监管态度长期以来把含有外资成分的任何实体均视为“外方单位”,《人类遗传资源管理问答》中关于外资成分的医院的答复亦印证了上述观点,但本次征求意见稿或将改变上述局面,第12条指出,外方单位是指境外组织及境外组织、个人设立或者实际控制的机构,并且通过枚举以及兜底条款规定了实际控制的四种情形。值得一提的在所列的四种情形中首次明确了50%这一公司法意义上的关键比例,一些具有外资参股,但所持股权未达50%的生物医药企业或将迎来重大利好。除此之外,在过往实践中,某些企业曾主张其VIE架构中的境内公司不应作为外方单位管理,随着征求意见稿将监管态度的阐明将再无争议,上述情形已完全落入第12条的规制中。但征求意见稿亦有表述不甚清晰,比如何种情形下可以构成“重大影响”?在资本市场中,一些从股权上完全谈不上控制的股东可通过诸如董事提名权等特殊的权利安排得以控制公司。对此,科技部会否参考资本市场乃至公司法意义上对实控人的认定标准,还有赖实践中进一步明确,但至少从征求意见稿看,科技部的监管态度已经悄然向着“实质>形式”的穿透式监管靠拢。
四、国际合作备案条件
——临床试验豁免审批的细化
我们再来谈谈生物医药行业特别关注的临床试验豁免审批问题。早在19年,条例第22条就已规定“为获得相关药品和医疗器械在我国上市许可,在临床机构利用我国人类遗传资源开展国际合作临床试验、不涉及人类遗传资源材料出境的,不需要审批。但是,合作双方在开展临床试验前应当将拟使用的人类遗传资源种类、数量及其用途向国务院科学技术行政部门备案。”征求意见稿第41条规定:【国际合作备案条件】为获得相关药品和医疗器械在我国上市许可,与中方单位合作在临床机构利用我国人类遗传资源开展国际合作临床试验、不涉及人类遗传资源材料出境的,符合以下情况需要将合作各方、拟使用的人类遗传资源种类、数量及其用途等向科技部备案,不需要审批:(一)所涉及的人类遗传资源采集、检测、分析和剩余样本处理等在临床机构内进行的;(二)所涉及的人类遗传资源在临床机构内采集,并由相关药品和医疗器械上市许可临床试验的临床试验方案指定的境内单位进行检测、分析和剩余样本处理的。临床机构是指在相关部门备案,可以开展临床研究的医疗机构、疾病预防控制机构等。为获得相关药品和医疗器械在我国上市许可的临床研究中如涉及探索性研究部分,应按照国际合作科学研究行政许可条件另行申报。比对二者不难看出,本次征求意见稿是对条例的进一步细化,将条例的“临床机构”进一步扩大到了“临床试验方案指定的境内单位”,生物医药行业中特有的CXO组织或将落入上述范围,这一变化体现了科技部对生物医药行业商业实践的回应。
五、结语
近几年我国在生物安全、个人信息保护、数据安全等领域打出了一揽子组合拳,加之生物医药行业的强监管属性,决定了主营业务涉及人类遗传资源的行业主体合规工作的重要性,合规出了问题,相关主体均将面临巨大的民事、行政乃至刑事法律风险,如何在满足法律和监管的强制要求下,保持生物医药行业的市场活力,这其中的平衡之道仍有待企业和监管部门在实践中共同努力。

